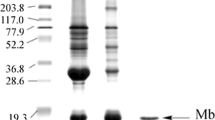
Summary
The heat stability of beef myoglobin was investigated by means of its solubility and intensity of protein bands separated by isoelectric focusing. A method for the sensitive determination of myoglobin in the extracts was developed based on its ability to form a red dye by the oxidative coupling of 2,4-dichlorophenol and 4-aminoantipyrine in the presence of hydrogen peroxide. By this method, myoglobin could be determined to a concentration of 0.01 mg/ml. For the detection of electro-focused myoglobins,o-dianisidine has proved to be the most sensitive compound. The myoglobin content of the extracts, according to the intensity of the myoglobin bands in the electrophoretic gel, decreased with increasing temperature and heating-time. However, the position of the bands was not changed by the heat treatment.
Zusammenfassung
Die Hitzestabilität des Myoglobins bei Rindfleisch wurde anhand seiner Löslichkeit und der Intensität der Proteinmuster nach isoelektrischer Focusierung untersucht. Für die empfindliche Bestimmung von Myoglobin in den Extrakten wurde eine photometrische Methode entwickelt, die auf einer durch Myoglobin katalysierten oxidativen Kupplung von 2,4-Dichlorphenol und 4-Aminoantipyrin in Gegenwart von Wasserstoffperoxid beruht, wobei ein roter Farbstoff gebildet wird. Mit dieser Methode konnten noch Myoglobinkonzentrationen bis 0,01 mg/ml erfaßt werden. Für den Nachweis der elektrofocussierten Myoglobine erwies sicho-Dianisidin von den untersuchten Substraten als am empfindlichsten. Die Myoglobingehalte der Extrakte nahmen mit steigender Hitzebelastung des Fleisches ab. Dementsprechend sank auch die Intensität der Myoglobinbanden mit steigender Temperatur und zunehmender Dauer der Erhitzung, ihre Lage im Elektrophoresegel blieb jedoch unverändert.
Similar content being viewed by others
Literatur
Tappel AL (1957) Food Res 22:404
Hamm R (1966) In: Briskey EJ, Cassens RG, Trautman JC (eds) Physiology and biochemistry of muscle as food. University of Wisconsin Press, Madison, Wisconsin, p 363
Bernofsky C, Fox JB, Schweigert BS (1959) Food Res 24:339
Ledward DA (1971) J Food Sci 36:883
Snyder HE, Ayres JC (1961) J Food Sci 26:469
Satterlee LD, Zachariah NY (1972) J Food Sci 37:909
Hayden AR (1979) J Food Sci 44:494
Höyem T, Thorson B (1970) J Agric Food Chem 18:737
Sinclair AJ, Slattery MJ (1982) Aust Vet J 58:79
Hofmann K, Blüchel E (1986) Fleischwirtschaft 66:916
Bauer F, Hofmann K (1987) Fleischwirtschaft 67:861
Broumand H, Ball CO, Stier EF (1958) Food Technol 12:65
Zukál E, Hamm R (1968) Fleischwirtschaft 48:185
Barham D, Trinder P (1972) Analyst 97:142
Owen JA, Silberman HJ, Got C (1958) Nature 182:1373
Delincee H, Radola BJ (1972) Anal Biochem 48:536
Kinzkofer A, Radola BJ (1983) Electrophoresis 4:408
Allen RC, Saravis CA, Maurer HR (1984) Gel Electrophoresis and Isoelectric Focusing of Proteins, de Gruyter, Berlin, p 235
Andrews PC, Krinsky NI (1982) Anal Biochem 127:346
Liem HH, Cardenas F, Tavassoli M, Poh-Fitzpatrik MB, Muller-Eberhard U (1979) Anal Biochem 98:388
Roberts PCB, Lawrie RA (1974) J Food Technol 9:345
Quinn JR, Pearson AM, Brunner JR (1964) J Food Sci 29:422
Quinn JR (1973) J Food Sci 38:289
Satterlee LD, Snyder HE (1969) J Chromatogr 41:417
Author information
Authors and Affiliations
Rights and permissions
About this article
Cite this article
Bauer, F., Hofmann, K. Einfluß des Erhitzens auf die Löslichkeit und das Elektrophoreseverhalten von Myoglobin. Z Lebensm Unters Forch 190, 414–419 (1990). https://doi.org/10.1007/BF01202559
Received:
Issue Date:
DOI: https://doi.org/10.1007/BF01202559